Zellreparatursystem könnte Proteinaggregation bei ALS verhindern
Neue Erkenntnisse zur Verhinderung von Proteinaggregaten
Eine bedeutende Entdeckung der Forscherteams der Goethe-Universität, der Johannes Gutenberg-Universität Mainz und der Universität Kiel könnte neue Perspektiven in der Behandlung neurodegenerativer Erkrankungen eröffnen. Spezifisch konzentriert sich die Forschung auf das Protein TDP-43, das bei Störungen in Nervenzellen zu schädlichen Aggregaten führt. Diese Aggregationen sind maßgeblich für die Entstehung von Krankheiten wie der Amyotrophen Lateralsklerose (ALS) und Alzheimer-Demenz verantwortlich. Das interdisziplinäre Projekt, das im Rahmen des Cluster4Future PROXIDRUGS durchgeführt wird, hat ans Licht gebracht, dass eine gezielte Manipulation von TDP-43 zur Verhinderung seiner Aggregation führen kann. Die Wissenschaftler haben herausgefunden, wie das Protein in das zelleigene Reparatursystem geleitet werden kann, wodurch potenziell schädliche Aggregate verhindert werden.
Mechanismus der TDP-43 Aggregation
Im Kontext von ALS werden jährlich etwa 2500 neue Fälle diagnostiziert, was die Erkrankung zwar relativ selten, jedoch sehr ernst macht. ALS ist eine progressive neurodegenerative Erkrankung, die die motorischen Neuronen im Gehirn und Rückenmark angreift, die für die Kontrolle der freiwilligen Muskulatur verantwortlich sind. Dieser Prozess führt zu einer schrittweisen Muskellähmung, die viele Betroffene auf einen Rollstuhl angewiesen macht und die grundlegenden alltäglichen Funktionen wie Sprechen, Schlucken und Atmen beeinträchtigt. In den motorischen Neuronen lagern sich schlecht lösliche Proteinaggregate ab, zu denen auch TDP-43 gehört. Während das Protein in gesunden Zellen überwiegend in löslicher Form im Zellkern vorliegt, bildet es in den Zellen von ALS-Patienten schlecht lösliche Aggregate, die die Funktionalität des Proteins beeinträchtigen und letztlich zum Zelltod führen.
Strategien zur Aggregatverhinderung
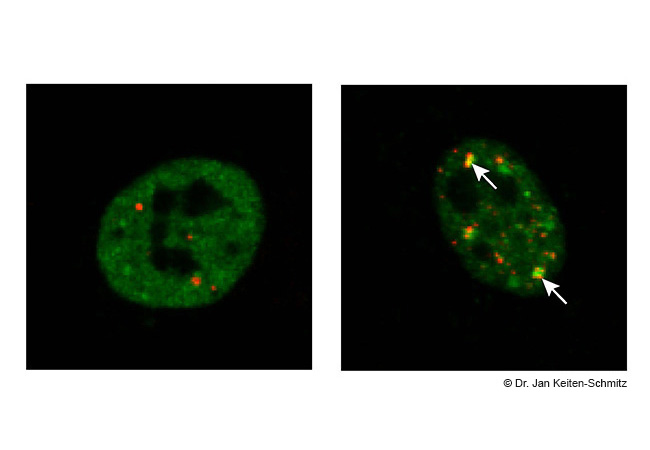
Die Forschergruppe unter der Leitung von Kristina Wagner, Dr. Jan Keiten-Schmitz und Professor Stefan Müller hat in ihren Experimenten Zellen verschiedenen Stressoren ausgesetzt, wie zum Beispiel Temperaturerhöhung oder chemischen Substanzen. Dies führte dazu, dass Teile des TDP-43-Proteins aus dem Zellkern in das Cytosol entlassen wurden, wo sie sich in sogenannten Stressgranulen anlagerten. Diese Stressgranulen erfüllen grundsätzlich eine schützende Funktion für die Zelle, indem sie als temporärer Speicher für essentielle Proteine fungieren, bis der Stress nachlässt. In den Zellen von ALS-Patienten hingegen führt eine Mutation des TDP-43 dazu, dass diese Granulen dauerhaft bestehen bleiben und die Neuronen schädigen.
Durch eine spezifische Verknüpfung von TDP-43 mit einem sogenannten SUMO-Protein gelang es den Wissenschaftlern, die Proteinaggregation zu verhindern. Diese SUMO-Proteine fungieren als eine Art „Straßendienst“ für TDP-43 und leiten das Protein zu den sogenannten Nukleoli, die als zelluläre Werkstätten agieren. Dadurch bleibt TDP-43 in löslicher Form und wird durch das Recycling-System der Zelle so behandelt, dass schädliche Aggregatformen entweder repariert oder abgebaut werden. Infolgedessen werden die schädlichen Insolubilitäts-Aggregate gar nicht erst gebildet, wodurch die Zellen geschützt werden.
Zukunftsperspektiven der Forschung
Die Wissenschaftler haben nun die nächsten Schritte im Blick, um chemische Verbindungen zu entwickeln, die SUMO und TDP-43 gezielt zusammenführen. Laut Professor Müller, dem Hauptverantwortlichen des Projekts, zeigen die Zellkulturexperimente vielversprechende Ergebnisse, die darauf hinweisen, dass dieser Ansatz dabei helfen kann, krankheitsfördernde TDP-43-Aggregate zu begrenzen. Obwohl der Weg zur Entwicklung eines potenziellen Medikaments zur Behandlung von ALS noch lang ist, stellt die Forschung einen vielversprechenden Ansatz dar. Es ist von großer Bedeutung, da Aggregationen des TDP-43-Proteins auch bei anderen neurodegenerativen Erkrankungen wie der frontotemporalen Demenz und bei rund der Hälfte der Alzheimer-Patienten beobachtet werden.
Fazit: Zukünftige Behandlungsansätze im Fokus
Die Forschungsergebnisse bieten fundamentale Einblicke in die Mechanismen der Proteinaggregation und eröffnen potenziell neue Therapiewege für neurodegenerative Krankheiten. Insbesondere der Ansatz, das Protein TDP-43 gezielt in den Reparaturprozess der Zelle zu integrieren, könnte nicht nur zur Behandlung von ALS, sondern auch von anderen verwandten Erkrankungen von Bedeutung sein. Es bleibt abzuwarten, welche konkreten Therapeutika aus diesen Erkenntnissen entwickelt werden können.